- Дихлорметан
-
Дихлорметан 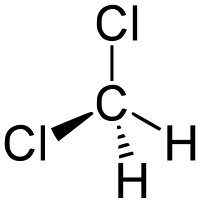
Общие Систематическое наименование дихлорметан Сокращения ДХМ Традиционные названия дихлорметан, метилен хлористый Химическая формула CH2Cl2 Эмпирическая формула CH2Cl2 Физические свойства Состояние (ст. усл.) подвижная прозрачная жидкость Примеси хлорметаны Молярная масса 84.9 г/моль Плотность 1.3266 г/см³ Термические свойства Температура плавления -96.7 °C Температура кипения 40 °C Температура вспышки 14 °C Критическая точка 245 Энтальпия образования (ст. усл.) -87.86 кДж/моль Удельная теплота испарения 336,4 Дж/кг Давление пара 470 Химические свойства Растворимость в воде при 20 °C 1.3 г/100 мл Оптические свойства Показатель преломления 1,4242 Классификация Рег. номер CAS 75-09-2 SMILES C(Cl)Cl RTECS PA8050000 Дихлормета́н (хлористый метилен, ДХМ, CH2Cl2) — прозрачная легкоподвижная и легколетучая жидкость с характерным для галогенпроизводных сладковатым запахом. Впервые был синтезирован в 1840 году выдерживанием смеси хлора с хлористым метилом на свету. В целом наиболее безопасен среди галогеналканов.
Содержание
Получение
Получают прямым хлорированием метана хлором в условиях радикального механизма при 400—500 °C при соотношении равном 5:1
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
- CHCl3 + Cl2 → CCl4 + HCl
В результате получается смесь всех возможных хлоридов: хлорметан, дихлорметан, хлороформ и четырёххлористый углерод, которые потом разделяются дистилляцией. После чего он имеет чистоту не менее 99,7 % В 1995 году годовое производство оценивалось в 500 миллионов тонн.
Свойства
Растворимость в воде 2% по массе (13 г/л), смешивается с большинством органических растворителей. Легколетуч (40 °C), образует азеотропную смесь с водой (т.кип. 38,1 °C, 98,5 % дихлорметана). Метиленхлорид (дихлорметан) реагирует с хлором с образованием хлороформа и четырёххлористого углерода. С йодом при 200 °C дает СН2l2, с бромом при 25-30 °C в присутствии алюминия — бромхлорметан. При нагревании с водой гидролизуется до СН2О и НСl. При нагревании со спиртовым раствором NH3 до 100—125 °C образует гексаметилентетрамин. Реакция с водным раствором NH3 при 200 °C приводит к метиламину,муравьиной кислоте и НСl. С ароматическими соединениями в присутствии АlСl3 метиленхлорид вступает в реакцию Фриделя — Крафтса, например с бензолом образует дифенилметан. [1]
Применение
Дешевизна, высокая способность растворять многие органические вещества, легкость удаления, относительно малая токсичность привела к широкому применению его как растворителя для проведения реакций, экстракций в том числе и в лабораториях. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворения смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов.
Также используется в хроматографии.
В промышленности в смеси с полимерами используют для создания формы, которая быстро застывает за счёт испарения дихлорметана. Он также используется для склеивания пластмасс: полистирола, поликарбонатов, полиэтилентерефталата, АБС-пластиков, но не для полиэтилена и полипропилена.
Очистка в лаборатории
- Промывают концентрированной серной кислотой, нейтрализуют щелочью и промывают водой. Сушат над поташом или безводным сульфатом магния и перегоняют. Для дополнительного обезвоживания используют молекулярные сита 4А[2].
- Кипятят с фосфорным ангидридом с последующей перегонкой. Хранят над молекулярными ситами 3А.
Специализированные применения
Дихлорметан используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.
Безопасность
Хотя он и является наименее ядовитым среди галогеналканов, но нужно быть осторожным при обращении, так как он очень летуч и может вызвать острое отравление. Работы следует проводить при работающей вытяжной вентиляции.
В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать отравление им. Длительный покровный контакт с дихлорметаном может вызвать его накопление в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и нейропатия.
На крысах показано, что он может вызывать рак лёгких, печени и поджелудочной железы. В то же время не было отмечено какого-либо влияния на развития эмбрионов у женщин, имевших контакт с дихлорметаном.
В Евросоюзе запрещены краски с дихлорметаном как для личного пользования, так и для профессонального применения.
Для регулярной работы с дихлорметаном не подходят перчатки из латекса или нитриловые.
Контакт дихлорметана с щелочными металлами приводит к взрыву.
ПДК в рабочей зоне 50мг/м³, в воде водоёмов не более 7.5 мг/л. КПВ 12-22 %
Примечания
Категории:- Галогензамещённые метаны
- Хлорорганические соединения
- Продукция основного органического синтеза
- Галогенированные растворители
Wikimedia Foundation. 2010.
