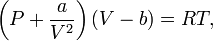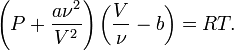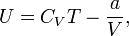- Уравнение состояния газа Ван-дер-Ваальса
-
Уравнение состояния 
Статья является частью серии «Термодинамика». Уравнение состояния идеального газа Уравнение Ван-дер-Ваальса Уравнение Дитеричи Разделы термодинамики Начала термодинамики Уравнение состояния Термодинамические величины Термодинамические потенциалы Термодинамические циклы Фазовые переходы править Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса.
Хотя модель идеального газа хорошо описывает поведение реальных газов при низких давлениях и высоких температурах, в других условиях её соответствие с опытом гораздо хуже. В частности, это проявляется в том, что реальные газы могут быть переведены в жидкое и даже в твёрдое состояние, а идеальные — не могут.
Для более точного описания поведения реальных газов при низких температурах была создана модель газа Ван-дер-Ваальса, вводящая поправку на конечный диаметр молекулы и на притяжение молекул на больших расстояниях, тогда как в идеальных газах частицы считаются точечными и никак не взаимодействуют на расстоянии.
Содержание
Термическое уравнение состояния
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
где
- P — давление,
- V — объём,
- T — абсолютная температура,
- R — универсальная газовая постоянная.
Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка a учитывает притяжение молекул, поправка b — объём занимаемый молекулами.
Для ν молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
Внутренняя энергия (калорическое уравнение состояния)
Внутренняя энергия одного моля газа Ван-дер-Ваальса может быть вычислена так:
где CV — молярная теплоёмкость при постоянном объёме, которая предполагается не зависит от температуры.
Таким образом, внутренняя энергия газа Ван-дер-Ваальса есть функция и температуры, и объёма, в следствие чего с ростом последнего (а значит, и расстояния между молекулами), при T = const, внутренняя энергия газа растет.
См. также
Литература
- Сивухин Д. В. Общий курс физики. — М.: Наука, 1975. — Т. II. Термодинамика и молекулярная физика. — 519 с.
- P.W. Atkins: Physical chemistry
Wikimedia Foundation. 2010.