- Реакция Стилла
-
Реакция Стилла
Реакция Стилла - химическая реакция, сочетание органического производного олова с sp2-гибридизованным органическим галлогенидом, катализируемая комплексами Pd(0).[1] [2] Реакция нашла широкое применение в органическом синтезе.
X может быть как галогеном (Cl, Br, I), так и псевдогалогенидом (трифлатом CF3SO3-) .[3][4]
Реакция Стилла была открыта в 1977 году Джоном Кеннетом Стиллом (John Kenneth Stille) и Дэвидом Мильштейном (David Milstein), который был постдоком в той же лаборатории. Реакция Стилла была использована для проведения около 50% всех реакций кросс-сочетания, опубликованных в 1992 году. Также реакция используется в промышленных процессах, в частности в синтезе фармацевтических препаратов.
Реакции Стилла были посвящены несколько обзорных публикаций.[5][6][7]
Содержание
Общие сведения
Обычно реакцию проводят в атмосфере инертного газа с использованием сухого и дегазированного растворителя, так как кислород воздуха может окислять палладиевый катализатор и провцировать гомо-сочетание органометаллического соединения, что в свою очередь приводит к уменьшению выхода целевого продукта кросс-сочетания.
Как органические соединения олова, в реакцию могут быть введены триметилстанильные или трибутилстанильные производные. Хотя триметилстанильные производные обладают более высокой реакционной способностью по сравнению с трибутилстанильными, их токсичность также примерно в 1000 раз выше, чем токсичность последних. Именно по этому триметилстанильные производные применяются лишь в случае крайней необходимости.
Механизм реакции
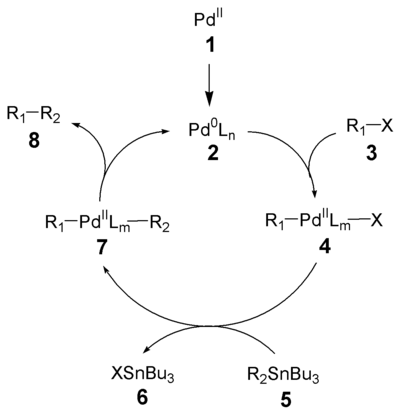
Механизм реакции Стилла довольно хорошо изучен.[8] [9] Первым процессом, инициирующем запуск каталитического цикла является восстановление палладиевого катализатора (1) в активный Pd(0) (2). Окислительное присоединение органического галогенида (3) дает цис-интермедиат, который быстро изомеризуется в транс-изомер 4.* Трансметаллирование органическим производным олова (5) приводит к формированию интермедиата 7. Последним процессом в этом каталитическом цикле является восстановительное элиминирование, которое приводит к желаемому продукту кросс-сочетания (8) и освобождению катализатора (2). Окислительное присоединение и восстановительное элиминирование проходят с сохранением стереохимической конфигурации исходных соединений.
Относительная скорость реакции с участием разных органических прозводных олова убывает в ряду:
- алкинил- > алкенил- > арил- > аллил- = бензил- > α-алкоксиалкил- > алкил-
Низкая реакционная способность алкильных производных олова является недостатком реакции. Однако, его можно преодолеть, если использовать как среду для проведения реакции полярные апротонные растворители, такие как ГМФТА, ДМФА или диоксан.
В 2007 году реакция Стилла подверглась изучению с помощью специального типа масс-спектрометрии, что позволило наблюдать каталитические частицы Pd(0)(PPh3)2, существование которых постулировалось, но не было до этого времени доказано прямым экспериментом. Также были обнаружены циклические интермедиаты трансметаллирования -Pd(II)-X-Sn-C-.[10].
Варианты проведения реакции
Для увеличения выхода в реакционную смесь часто добавляют хлорид лития. Этот реагент стабилизирует интермедиат, образуемый окислительным присоединением катализатора, таким образом ускоряя реакцию.
Специфичность реакции Стилла может быть улучшена добавлением стехиометрического количества йодида меди или солей Mn(II).[11] [12][13]
Было показано, что в присутствии солей Cu(I), эффективным катализатором реакции может быть палладий на угле.[14] [15]
Примечания
- ↑ Kosugi, M. et al. Chem. Letters 1977, 301.
- ↑ Milstein, D.; Stille, J. K. J. Am. Chem. Soc. 1978, 100, 3636. (DOI:10.1021/ja00479a077)
- ↑ Scott, W. J.; Crisp, G. T.; Stille, J. K. Organic Syntheses, Coll. Vol. 8, p.97 (1993); Vol. 68, p.116 (1990). (Article)
- ↑ Stille, J. K.; Echavarren, A. M.; Williams, R. M.; Hendrix, J. A. Organic Syntheses, Coll. Vol. 9, p.553 (1998); Vol. 71, p.97 (1993). (Article)
- ↑ Stille, J. K. Angew. Chem. Int. Ed. Engl. 1986, 25, 508–524. (Review)
- ↑ Farina, V.; Krishnamurthy, V.; Scott, W. J. Org. React. 1998, 50, 1–652. (Review)
- ↑ Mitchell, T. N. Synthesis 1992, 803-815. (Review)
- ↑ Casado, A. L.; Espinet, P. Organometallics 1998, 17, 954–959.
- ↑ Casado, A. L.; Espinet, P. J. Am. Chem. Soc. 1998, 120, 8978–8985. (DOI:10.1021/ja9742388)
- ↑ The Mechanism of the Stille Reaction Investigated by Electrospray Ionization Mass Spectrometry Leonardo S. Santos, Giovanni B. Rosso, Ronaldo A. Pilli, and Marcos N. Eberlin J. Org. Chem.; 2007; 72(15) pp 5809 - 5812; (Note) DOI:10.1021/jo062512n
- ↑ Liebeskind, L. S.; Peña-Cabrera, E. Organic Syntheses, Coll. Vol. 10, p.9 (2004); Vol. 77, p.135 (2000). (Article)
- ↑ Farina, V.; Kapadia, S.; Krishnan, B.; Wang, C.; Liebeskind, L. S. J. Org. Chem. 1994, 59, 5905.
- ↑ Liebeskind, L. S.; Fengl, R. W. J. Org. Chem. 1990, 55, 5359.
- ↑ Roth, G. P.; Farina, V.; Liebeskind, L. S.; Peña-Cabrera, E. Tetrahedron Lett. 1995, 36, 2191.
- ↑ Renaldo, A. F.; Labadie, J. W.; Stille, J. K. Organic Syntheses, Coll. Vol. 8, p.268 (1993); Vol. 67, p.86 (1989). (Article)
См также
Внешние ссылки
- обзор применения реакции Стилла от Myers group (англ).
- Реакция Стилла на organic-chemistry.org (англ.)
Wikimedia Foundation. 2010.
Реакция Стилле — Реакция Стилле вариант реакции кросс сочетания, в которой взаимодействие арил , алкенил , алкинил и алкилстаннанов с арил или алкенилгалогенидами, трифлатами (трифторметилсульфонатами), арилдиазониевыми или иодониевыми солями,… … Википедия
Реакция Сузуки — Реакция Сузуки органическая реакция арил винил бороновых кислот с арил или винил галлидами, катализируемая комплексами Pd(0).[1][2] Реакция Сузуки широко используется в препаративной органической химий для получения полиолефинов, стиролов, а… … Википедия
Реакция Судзуки — Реакция Судзуки органическая реакция арил и винилборных кислот с арил или винилгалогенидами, катализируемая комплексами Pd(0).[1][2] Реакция Судзуки широко используется в препаративной органической химии для получения полиолефинов, стиролов … Википедия
Именные реакции в органической химии — В органической химии существует огромное число реакций, носящих имя исследователя, открывшего или исследовавшего данную реакцию. Часто в названии реакции фигурируют имена нескольких ученых: это могут быть авторы первой публикации (например,… … Википедия
Лимфаденопатия — МКБ 10 I88.88., L04.04., R59.159.1 МКБ 9 … Википедия
Ревматоидный артрит — Эта статья или раздел нуждается в переработке. Пожалуйста, улучшите статью в соответствии с правилами написания статей … Википедия
Ревматоидный Артрит — МКБ 10 M05. M06. МКБ 9 … Википедия
Халл, Кларк Леонард — В Википедии есть статьи о других людях с такой фамилией, см. Халл. Кларк Леонард Халл Clark Leonard Hull … Википедия
Лёгочное сердце — Легочное сердце (cor pulmonale) патологическое состояние, характеризующееся гиперфункцией миокарда правых отделов сердца вследствие легочной артериальной гипертензии, обусловленной патологией бронхолегочного аппарата, сосудов легких или торако… … Медицинская энциклопедия