- Распределение Максвелла
-
Распределение Ма́ксвелла — распределение вероятности, встречающееся в физике и химии. Оно лежит в основании кинетической теории газов, которая объясняет многие фундаментальные свойства газов, включая давление и диффузию. Распределение Максвелла также применимо для электронных процессов переноса и других явлений. Распределение Максвелла применимо к множеству свойств индивидуальных молекул в газе. О нем обычно думают как о распределении энергий молекул в газе, но оно может также применяться к распределению скоростей, импульсов, и модуля импульсов молекул. Также оно может быть выражено как дискретное распределение по множеству дискретных уровней энергии, или как непрерывное распределение по некоторому континууму энергии.
Распределение Максвелла может быть получено при помощи статистической механики (см. происхождение статсуммы). Как распределение энергии, оно соответствует самому вероятному распределению энергии, в столкновительно-доминируемой системе, состоящей из большого количества невзаимодействующих частиц, в которой квантовые эффекты являются незначительными. Так как взаимодействие между молекулами в газе является обычно весьма небольшим, распределение Максвелла даёт довольно хорошее приближение ситуации, существующей в газе.
Во многих других случаях, однако, даже приблизительно не выполнено условие доминирования упругих соударений над всеми другими процессами. Это верно, например, в физике ионосферы и космической плазмы, где процессы рекомбинации и столкновительного возбуждения (то есть излучательные процессы) имеют большое значение, в особенности для электронов. Предположение о применимости распределения Максвелла дало бы в этом случае не только количественно неверные результаты, но даже предотвратило бы правильное понимание физики процессов на качественном уровне. Также, в том случае где квантовая де Бройлева длина волны частиц газа не является малой по сравнению с расстоянием между частицами, будут наблюдаться отклонения от распределения Максвелла из-за квантовых эффектов.
Распределение энергии Максвелла может быть выражено как дискретное распределение энергии:
 ,
,
где
 является числом молекул имеющих энергию
является числом молекул имеющих энергию  при температуре системы
при температуре системы  ,
,  является общим числом молекул в системе и
является общим числом молекул в системе и  — постоянная Больцмана. (Отметьте, что иногда вышеупомянутое уравнение записывается с множителем
— постоянная Больцмана. (Отметьте, что иногда вышеупомянутое уравнение записывается с множителем  , обозначающим степень вырождения энергетических уровней. В этом случае сумма будет по всем энергиям, а не всем состояниям системы). Поскольку скорость связана с энергией, уравнение (1) может использоваться для получения связи между температурой и скоростями молекул в газе. Знаменатель в уравнении (1) известен как каноническая статистическая сумма.
, обозначающим степень вырождения энергетических уровней. В этом случае сумма будет по всем энергиям, а не всем состояниям системы). Поскольку скорость связана с энергией, уравнение (1) может использоваться для получения связи между температурой и скоростями молекул в газе. Знаменатель в уравнении (1) известен как каноническая статистическая сумма.Содержание
Распределение Максвелла
Распределение по вектору импульса
Представленное ниже очень сильно отличается от вывода, предложенного Джеймсом Клерком Максвеллом и позже описанного с меньшим количеством предположений Людвигом Больцманом.
В случае идеального газа, состоящего из невзаимодействующих атомов в основном состоянии, вся энергия находится в форме кинетической энергии. Кинетическая энергия соотносится с импульсом частицы следующим образом
 ,
,
где
 — квадрат вектора импульса
— квадрат вектора импульса ![\,\mathbf{p}=[p_x,p_y,p_z]](a12a5a8f6e3d16ca8698c46fdd0714d3.png) .
.Мы можем поэтому переписать уравнение (1) как:
![\frac {N_i} {N} = \frac {1} {Z} \exp \left [\frac {-(p_x^2 + p_y^2 + p_z^2)} {2mkT} \right] \qquad\qquad (3)](83837eab6c3309cc6388bd336bcc57af.png) ,
,
где
 — статсумма, соответствующая знаменателю в уравнении (1),
— статсумма, соответствующая знаменателю в уравнении (1),  — молекулярная масса газа,
— молекулярная масса газа,  — термодинамическая температура, и
— термодинамическая температура, и  — постоянная Больцмана. Это распределение
— постоянная Больцмана. Это распределение  пропорционально функции плотности вероятности
пропорционально функции плотности вероятности  нахождения молекулы в состоянии с этими значениями компонентов импульса. Таким образом:
нахождения молекулы в состоянии с этими значениями компонентов импульса. Таким образом:Постоянная нормировки C, определяется из условия, в соответствии с которым вероятность того, что молекулы имеют какой-либо вообще импульс, должна быть равна единице. Поэтому интеграл уравнения (4) по всем значениям
 и
и  должен быть равен единице. Можно показать, что:
должен быть равен единице. Можно показать, что:![\iiint\limits_{-\infty}^{+\infty} \frac {1} {Z} \exp \left [\frac {-(p_x^2 + p_y^2 + p_z^2)} {2mkT} \right] \, dp_x \, dp_y \, dp_z = \frac {1} {Z} \left (2\pi m kT \right) ^ {3/2} \qquad\qquad (5)](dd490d33d9f9a654ebac170bef4d9085.png) .
.
Таким образом, чтобы интеграл в уравнении (4) имел значение 1 необходимо, чтобы
 .
.
Подставляя выражение (6) в уравнение (4) и используя тот факт, что
 , мы получим
, мы получим![f_\mathbf {p} (p_x, p_y, p_z) = \sqrt {\left (\frac {1} {2 \pi mkT} \right) ^3} \exp \left [\frac {-(p_x^2 + p_y^2 + p_z^2)} {2mkT} \right] \qquad\qquad (7)](a06f26edc01d101f0f73df36ac2ff17f.png) .
.
Распределение по вектору скорости
Учитывая, что плотность распределения по скоростям
 пропорциональна плотности распределения по импульсам:
пропорциональна плотности распределения по импульсам:и используя
 мы получим:
мы получим:![f_\mathbf {v} (v_x, v_y, v_z) = \sqrt {\left (\frac {m} {2 \pi kT} \right) ^3} \exp \left [\frac {-m (v_x^2 + v_y^2 + v_z^2)} {2kT} \right] \qquad\qquad (8)](8b1370d4599c108dac9c9d95a54755c0.png) ,
,
что является распределением Максвелла по скоростям. Вероятность обнаружения частицы в бесконечно малом элементе
 около скорости
около скорости ![\,\mathbf{v}=[v_x,v_y,v_z]](96af929d8dac335387dd8824f4037d10.png) равна
равнаРаспределение по абсолютной величине импульса
Интегрируя, мы можем найти распределение по абсолютной величине импульса
Распределение по энергии
Наконец, используя соотношения
 и
и  , мы получаем распределение по кинетической энергии:
, мы получаем распределение по кинетической энергии:Распределение по проекции скорости
Распределение Максвелла для вектора скорости
![\,[v_x,v_y,v_z]](d2579147e857ecc1957f75833fd1c2b9.png) — является произведением распределений для каждого из трех направлений:
— является произведением распределений для каждого из трех направлений: ,
,
где распределение по одному направлению:
Это распределение имеет форму нормального распределения. Как и следует ожидать для покоящегося газа, средняя скорость в любом направлении равна нулю.
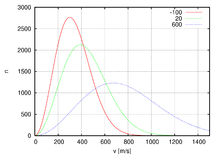
Распределение по модулю скоростей
Обычно, более интересно распределение по абсолютному значению, а не по проекциям скоростей молекул. Модуль скорости, v определяется как:
поэтому модуль скорости всегда будет больше или равен нулю. Так как все
 распределены нормально, то
распределены нормально, то  будет иметь хи-квадрат распределение с тремя степенями свободы. Если
будет иметь хи-квадрат распределение с тремя степенями свободы. Если  — функция плотности вероятности для модуля скорости, то:
— функция плотности вероятности для модуля скорости, то: ,
,
где
таким образом, функция плотности вероятности для модуля скорости равна
Характерная скорость
Хотя Уравнение (11) дает распределение скоростей, или, другими словами, долю молекул, имеющих специфическую скорость, часто более интересны другие величины, такие как средние скорости частиц. В следующих подразделах мы определим и получим наиболее вероятную скорость, среднюю скорость и среднеквадратичную скорость.
Наиболее вероятная скорость
наиболее вероятная скорость,
 — вероятность обладания которой любой молекулой системы максимальна, и которая соответствует максимальному значению
— вероятность обладания которой любой молекулой системы максимальна, и которая соответствует максимальному значению  . Чтобы найти её, необходимо вычислить
. Чтобы найти её, необходимо вычислить  , приравнять её нулю и решить относительно
, приравнять её нулю и решить относительно  :
:Средняя скорость
Подставляя
 и интегрируя, мы получим
и интегрируя, мы получимСреднеквадратичная скорость
Подставляя
 и интегрируя, мы получим
и интегрируя, мы получимВывод распределения по Максвеллу
Получим теперь формулу распределения так, как это делал сам Джеймс Клерк Максвелл.
Рассмотрим пространство скоростных точек (каждую молекулу представляем как точку в системе координат ) в стационарном состоянии газа. Выберем бесконечно малый элемент объема
) в стационарном состоянии газа. Выберем бесконечно малый элемент объема  . Так как газ стационарный, количество скоростных точек в
. Так как газ стационарный, количество скоростных точек в  остается неизменным с течением времени. Пространство скоростей изотропно, поэтому функции плотности вероятности для всех направлений одинаковы.
остается неизменным с течением времени. Пространство скоростей изотропно, поэтому функции плотности вероятности для всех направлений одинаковы.Максвелл предположил, что распределения скоростей по направлениям статистически независимы, то есть компонента
 скорости молекулы не зависит от
скорости молекулы не зависит от  и
и  компонент.
компонент. - фактически вероятность нахождения скоростной точки в объеме
- фактически вероятность нахождения скоростной точки в объеме  .
.
Правая часть не зависит от
 и
и  , значит и левая от
, значит и левая от  и
и  не зависит. Однако
не зависит. Однако  и
и  равноправны, следовательно левая часть не зависит также и от
равноправны, следовательно левая часть не зависит также и от  . Значит данное выражение может лишь равняться некоторой константе.
. Значит данное выражение может лишь равняться некоторой константе.Теперь нужно сделать принципиальный шаг — ввести температуру. Кинетическое определение температуры (как меры средней кинетической энергии движения молекул):
где
 Дж/К - постоянная Больцмана.
Дж/К - постоянная Больцмана.Ввиду равноправия всех направлений:
Чтобы найти среднее значение
 , проинтегрируем её вместе с функцией плотности вероятности от минус до плюс бесконечности:
, проинтегрируем её вместе с функцией плотности вероятности от минус до плюс бесконечности:Отсюда найдём
 :
:Функция распределения плотности вероятности для
 (для
(для  и
и  аналогично):
аналогично):Теперь рассмотрим распределение по величине скорости. Вернемся в пространство скоростных точек. Все точки с модулем скорости
![v \subset [v; v+dv] \!](128aae3d8f0fae0b2ee5ee2798f3eedc.png) лежат в шаровом слое радиуса
лежат в шаровом слое радиуса  и толщины
и толщины  , и
, и  - объем этого шарового слоя.
- объем этого шарового слоя.Таким образом, мы получили функцию плотности вероятности
 , которая и является распределением Максвелла.
, которая и является распределением Максвелла.Границы применимости
Условия применимости распределения Максвелла:
- 1. Равновесное состояние системы, состоящей из большого числа частиц.
- 2. Изотропная система.
- 3. Классическая система. Это значит, что система должна быть не релятивистской и не квантовой (взаимодействие частиц допускается, но только зависящее от относительного положения частиц).
Условия классического рассмотрения
Рассматриваем объем xyz в газе, на который в среднем приходится 1 частица. Чтобы неопределенности в координате и импульсе не играли роли и применялась бы классическая, а не квантовая механика, должны выполняться соотношения:
 где
где  - постоянная Планка.
- постоянная Планка. - объем, приходящийся на частицу - это полный (единичный) объем, поделенный на количество частиц.
- объем, приходящийся на частицу - это полный (единичный) объем, поделенный на количество частиц.


 - температура вырождения.
- температура вырождения.
При температурах ниже
 газ становится вырожденным, и распределение Максвелла к нему применять нельзя.
газ становится вырожденным, и распределение Максвелла к нему применять нельзя.См. также
- Статистика Бозе — Эйнштейна
- Статистика Ферми — Дирака
- Статистика Максвелла — Больцмана
- Опыт Ламмерта
- Опыт Штерна
- Распределение Гиббса
Ссылки
Категории:- Физические законы
- Молекулярная физика
- Непрерывные распределения
- Статистическая физика
Wikimedia Foundation. 2010.

![f_\mathbf {p} (p_x, p_y, p_z) = \frac {C} {Z} \exp \left [\frac {-(p_x^2 + p_y^2 + p_z^2)} {2mkT} \right] \qquad\qquad (4)](62939d7970fc6dd8fa683b70c565e208.png)


![f_p = \int _ {\theta=0} ^ {\pi} \int _ {\phi=0} ^ {2\pi} ~ f_\mathbf {p} p^2 \sin (\theta) \, d\theta \, d\phi=4\pi\sqrt {\left (\frac {1} {2 \pi mkT} \right) ^3} ~p^2 \exp \left [\frac {-p^2} {2mkT} \right]](592591e1b708b727e616bff3e8444948.png)
![f_E=f_p \frac{dp} {dE} =2\sqrt {\frac {E} {\pi (kT) ^3}} ~ \exp\left [\frac {-E} {kT} \right]](ae489fb3146a61f6fa52cc411f8f1700.png)
![f_v (v_i) = \sqrt {\frac {m} {2 \pi kT}} \exp \left [\frac {-mv_i^2} {2kT} \right] \qquad\qquad (9)](27b783d8fbbfd5f6cccfbd70ef465260.png)



![\frac {df (v)} {dv} = \left (\frac {m} {2 \pi kT} \right) ^ {3/2} \exp \left (-mv^2/2kT \right) \left [8\pi v + 4 \pi v^2 (-mv/kT) \right] = 0\qquad\qquad (12)](b48d50215acdbf42d121d0bda0ed9662.png)


















![\frac{kT}{m} = \int\limits_{-\infin} ^ {\infin} {v_x}^2 \, \varphi(v_x) \, dv_x = \sqrt{\frac{\alpha}{2 \pi}} \, \int\limits_{-\infin} ^ {\infin} v_x^2 \, e^{-\frac{\alpha {v_x}^2}{2}} \, dv_x = \sqrt{\frac{\alpha}{2 \pi}}\left[ -2 \, \frac{\delta}{\delta \alpha} \, \int\limits_{-\infin} ^ {\infin} e^{-\frac{\alpha {v_x}^2}{2}} \, dv_x \right] = -2 \, \sqrt{\frac{\alpha}{2 \pi}} \, \frac{\delta}{\delta \alpha} \sqrt{\frac{2 \pi}{\alpha}} = - 2 \sqrt{\alpha} (-\frac{1}{2} \alpha^{-\frac{3}{2}}) = \frac{1}{\alpha} \!](c560c9947dd31bba2ebfdfd7f238c93b.png)




