- Изоциановая кислота
-
Изоциановая кислота 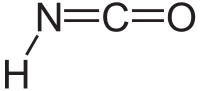
Общие Химическая формула HN=C=O Эмпирическая формула CHNO Физические свойства Молярная масса 43.03 г/моль Плотность 1.14 г/см³ Термические свойства Температура плавления -86 °C [1] °C Температура кипения 23.5 °C Энтальпия образования (ст. усл.) -153.3 кДж/моль Удельная теплота испарения 28,4 кДж/моль Давление пара 36,13 кПа (273,16 К) Химические свойства pKa 3,47 (в водн. растворах) Структура Кристаллическая структура кристаллы ромбической сингонии (а = 1,082 нм, b = 0,523 нм, с = 0,357 нм, Z = 4, пространств. группа Pnma[2]) Классификация Рег. номер CAS 75-13-8 SMILES O=C=[N@H] Изоциановая кислота — бесцветная жидкость с резким запахом, схожим с запахом уксусной кислоты, является стабильной таутомерной формой циановой кислоты HOCN. Токсична. Соли циановой кислоты впервые описаны Вёлером в 1824 г., сама циановая кислота получена Либихом и Вёлером в 1830 г.[3].
Свойства и реакционная способность
Изоциановая кислота является слабой кислотой (Ka = 3,47·10−4 в водных растворах), стабильна в растворах в диэтиловом эфире, бензоле и толуоле; в водных растворах гидролизуется с образованием диоксида углерода и аммиака, гидролиз ускоряется в присутствии минеральных кислот:
- HNCO + H2O
 NH3 + CO2
NH3 + CO2
Атом углерода изоциановой кислоты является электрофильным центром: циановая кислота взаимодействует с такими нуклеофилами, как аммиак, амины и спирты, образуя соответствующие продукты присоединения.
При взаимодействии изоциановой кислоты со спиртами образуются уретаны:
- ROH + HNCO
 H2NCOOR ,
H2NCOOR ,
которые с избытком изоциановой кислоты образуют эфиры аллофановой кислоты:
- HNCO + H2N-CO-COOR
 H2N-СО-NH-COOR
H2N-СО-NH-COOR
Взаимодействие изоциановой кислоты с аммиаком ведет к образованию цианата аммония, который при нагревании изомеризуется в мочевину, эта реакция, открытая Вёлером в 1828 г., стала первым синтезом органического соединения из неорганических веществ[4]:
Аналогично реагирует изоциановая кислота и с другими азотистыми нуклеофилами: так, амины присоединяются к ней с образованием замещенных мочевин[5], [6]:
- RNH2 + HNCO
 RNHCONH2
RNHCONH2
и гидразин, образующий в реакции с изоциановой кислотой семикарбазид:
- NH2NH2 + HNCO
 NH2NHCONH2
NH2NHCONH2
Безводная изоциановая кислота самопроизвольна полимеризуется в твердую белую массу, состоящую преимущественно из циамелида — линейного полимера (-O-C(=NH)-)n, который при нагревании деполимеризуется с образованием исходной кислоты.
Под действием триэтилфосфина и третичных аминов изоциановая кислота тримеризуется с образованием циануровой кислоты (2,3,5-тригидрокси-сим-триазина).
Подобно минеральным кислотам, изоциановая кислота присоединяется к алкенам с образованием алкилизоцианатов, легче всего реагируют алкены с терминальной двойной связью и электрондонорным заместителем при двойной связи, например, виниловые эфиры:
- RO-CH=CH2 + HNCO
 RO-CH(CH3)-N=C=O
RO-CH(CH3)-N=C=O
Аналогично с изоциановой кислотой реагируют и стирол и его гомологи, изопрен и другие алкены, проведение реакции с неактивированными электрондонорными заместителями алкенами идет в более жестких условиях и под действием катализаторов (эфират трифторида бора, p-толуолсульфокислота)[7].
Синтез
Лабораторным методом синтеза изоциановой кислоты является термическое разложение циануровой кислоты. Реакцию проводят при ~400 °C, используя очищенную циануровую кислоту (примеси могут привести к взрывному разложению), в промышленности изоциановую кислоту получают каталитическим окислением синильной кислоты при 630—650 °C на контактной сетке из золота.
Цианаты могут быть получены окислением цианидов щелочных металлов: так, при плавлении цианида калия на воздухе происходит его загрязнение образующимся вследствие окисления цианатом калия, окисление цианидов натрия и калия воздухом или кислородом в присутствии никеля является промышленным методом синтеза цианатов. Цианаты натрия и калия также синтезируют сплавлением соответствующих цианидов с оксидом свинца или свинцовым суриком Рb3О4. Перекись водорода также окисляет цианиды до цианатов.
Примечания
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ Dohlen, W. C. v.; G. B. Carpenter (1955). «The crystal structure of isocyanic acid». Acta Crystallographica 8 (10): 646-651. DOI:10.1107/S0365110X55002016. ISSN 0365110X. Проверено 2011-04-20.
- ↑ Liebig, J.; Wöhler, F. (1830). «Untersuchungen über die Cyansäuren». Ann. Phys. 20 (11): 394. DOI:10.1002/andp.18300961102.
- ↑ Nicolaou, K.C., Montagnon, T. Molecules That Changed The World. — Wiley-VCH, 2008. — С. 11. — ISBN 978-3-527-30983-2
- ↑ Frederick Kurzer. Arylureas. I. Cyanate method. p-Bromophenylurea. Organic Syntheses, Coll. Vol. 4, p.49 (1963); Vol. 31, p.8 (1951).
- ↑ N. A. Lange, F. E. Sheibley. Benzoylene urea. Organic Syntheses, Coll. Vol. 2, p.79 (1943); Vol. 17, p.16 (1937).
- ↑ Katritzky Alan R. Comprehensive Organic Functional Group Transformations: Synthesis: carbon with two attached heteroatoms with at least one carbon-to-heteroatom multiple link. — Elsevier. — ISBN 9780080423265 (pp. 985—986)
 Категории:
Категории:- Неорганические кислоты
- Цианаты
- Изоцианаты
- Соединения водорода
- HNCO + H2O
Wikimedia Foundation. 2010.

