- Индольные алкалоиды
-
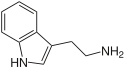
 Структурная формула индола
Структурная формула индола
Индо́льные алкало́иды — класс алкалоидов, содержащих в своей структуре ядро индола или его производных[1]. Один из наиболее многочисленных классов алкалоидов (наряду с изохинолиновыми). Известно более 4100 индольных алкалоидов[2]. Значительная часть индольных алкалоидов содержит также изопреноидные структурные элементы. Многие индольные алкалоиды обладают физиологической активностью, некоторые из них находят применение в медицине. Биогенетическим предшественником индольных алкалоидов является аминокислота триптофан[1].
Содержание
История
С действием некоторых индольных алкалоидов человечество знакомо давно. Ацтеки в древности использовали галлюциногенные грибы рода Псилоцибе, содержащие алкалоиды псилоцибин и псилоцин. Раувольфия змеиная, содержащая резерпин, ещё за 1000 лет до н. э. использовалась в Индии в качестве лекарственного средства. Корни ибоги, содержащей ибогаин, использовались народами Африки в качестве стимулятора ЦНС. Физостигма ядовитая использовалась народами Нигерии для установления вины: подсудимому давали настойку её семян, после чего, если она выходила со рвотой, его оправдывали, в противном случае он умирал от паралича сердца и дыхания. Действующим веществом физостигмы является физостигмин (эзерин)[3].
Поражение спорыньёй посевов злаков в древние времена и в средневековье неоднократно приводила к эпидемиям эрготизма. Связь между спорыньёй и эрготизмом была установлена только в 1717 г., а алкалоид эрготамин, одно из основных действующих веществ спорыньи, был выделен в 1918 г.[4]
Первый изолированный индольный алкалоид, стрихнин, был выделен Пеллетье и Каванту в 1818 г. из растений рода Стрихнос (лат. Strychnos). Правильная структурная формула стрихнина была определена только в 1947 г., хотя факт присутствия в структуре стрихнина индольного ядра был установлен несколько раньше[5][6].
Сам индол был впервые получен Байером в 1866 г. в процессе расщепления индиго[7].
Классификация
В зависимости от путей биосинтеза различают неизопреноидные и изопреноидные индольные алкалоиды. Последние включают в себя терпеноидные структурные элементы, синтезируемые живыми организмами из диметилаллилпирофосфата (англ. Dimethylallyl pyrophosphate) (DMAPP) и/или изопентенилпирофосфата (англ. Isopentenyl pyrophosphate) (IPP)[8]:
- Неизопреноидные:
- простые производные индола;
- простые производные β-карболина;
- пирролоиндольные алкалоиды.
- Изопреноидные:
- гемитерпеноиды: алкалоиды спорыньи;
- монотерпеноиды.
Существуют также чисто структурные классификации, основанные на наличии в углеродном скелете молекулы алкалоида элементов карбазола, β-карболина и т. п.[9]
Кроме того, известно около 200 димерных индольных алкалоидов (бисиндольных алкалоидов), молекулы которых содержат по два индольных ядра[10].
Неизопреноидные индольные алкалоиды
Число известных неизопреноидных индольных алкалоидов невелико по сравнению с общим числом известных индольных алкалоидов[1].
Простые производные индола
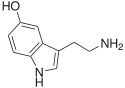
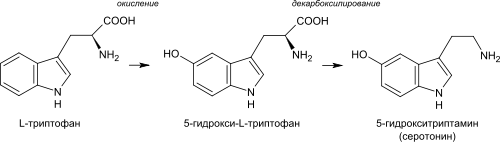
Одними из простейших и вместе с тем широко распространённых природных производных индола являются биогенные амины триптамин и 5-гидрокситриптамин (серотонин)[11]. Хотя отнесение их к алкалоидам не является общепринятым[12], оба этих соединения встречаются как в растительном, так и в животном мире[13]. Скелет триптамина входит в структуру подавляющего большинства индольных алкалоидов[14].
N,N-диметилтриптамин (ДМТ), псилоцин и его фосфорилированное производное псилоцибин также относятся к простейшим производным триптамина[13].
Некоторые простые индольные алкалоиды не содержат структурного элемента триптамина, в частности, грамин и гликозолин (последний является производным карбазола)[15].
Простые производные β-карболина
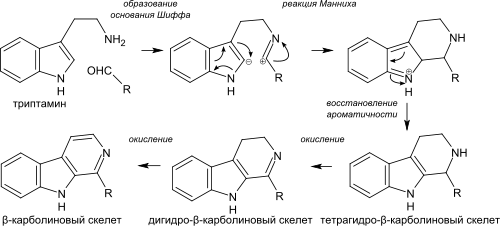
Распространённость β-карболиновых алкалоидов связана с простотой формирования ядра β-карболина из триптамина в процессе внутримолекулярной реакции Манниха. К простым (неизопреноидным) производным β-карболина относятся, например, гармин, гармалин и гарман[16], а также чуть более сложного строения кантинон[17].
Гармалин был впервые выделен Гёбелем в 1841 г., гармалин — Фритче в 1847 г.[18]
Пирролоиндольные алкалоиды
Пирролоиндольные алкалоиды — сравнительно малочисленная группа производных триптамина, образующихся посредством метилирования индольного ядра в позиции 3 и последующей нуклеофильной атаки на атом углерода в позиции 2 с замыканием этиламинной группы в кольцо. Типичным представителем этой группы является физостигмин (эзерин)[19].
Физостигмин был открыт Йобстом и Гессе в 1864 г.[20]
Изопреноидные индольные алкалоиды
 Структурная формула лизергиновой кислоты. Жёлтым отмечен структурный элемент, происходящий от триптофана, синим — изопреноидный структурный элемент, происходящий от DMAPP
Структурная формула лизергиновой кислоты. Жёлтым отмечен структурный элемент, происходящий от триптофана, синим — изопреноидный структурный элемент, происходящий от DMAPP
Изопреноидные индольные алкалоиды включают в себя как остатки триптофана или триптамина, так и изопреноидные структурные элементы, производные от диметилаллилпирофосфата (англ. Dimethylallyl pyrophosphate) и изопентенилпирофосфата (англ. Isopentenyl pyrophosphate)[1].
Алкалоиды спорыньи
Алкалоиды спорыньи (эргоалкалоиды, англ. Ergot alkaloids) представляют собой класс гемитерпеноидных индольных алкалоидов, родственных лизергиновой кислоте, которая, в свою очередь, образуется в процессе многоступенчатой реакции, вовлекающей триптофан и диметилаллилпирофосфат (DMAPP).
Многие алкалоиды спорыньи представляют собой амиды лизергиновой кислоты, простейшим из которых является эргин (англ. Ergine) (лизергамид). Более сложные можно подразделить на две группы[21][22]:
- Производные аминоспиртов, растворимые в воде, например, эргометрин (другие названия: эргоновин и эргобазин) и его изомер эргометринин (эргоновинин, эргобазинин);
- Производные полипептидов, нерастворимые в воде, делящиеся на группы:
- группа эрготамина: собственно эрготамин, эргозин, а также их изомеры;
- группа эргоксина: эргостин, эргоптин, эргонин и их изомеры;
- группа эрготоксина: эргокристин, α-эргокриптин, β-эргокриптин, эргокорнин и их изомеры.
Эрготинин, открытый в 1875 г., и эрготоксин (1906 г.) впоследствии оказались смесями нескольких алкалоидов. В чистом виде первые алкалоиды спорыньи, эрготамин и его изомер эрготаминин, были выделены Штоллем в 1918 г.[22]
Монотерпеноиды
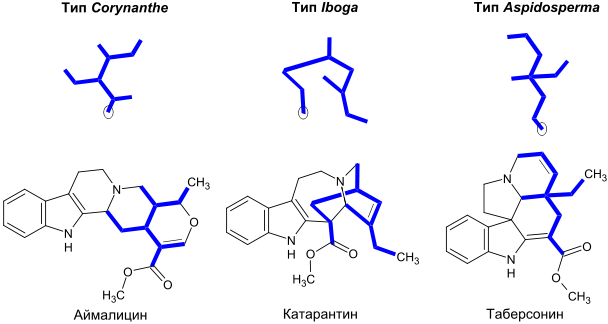
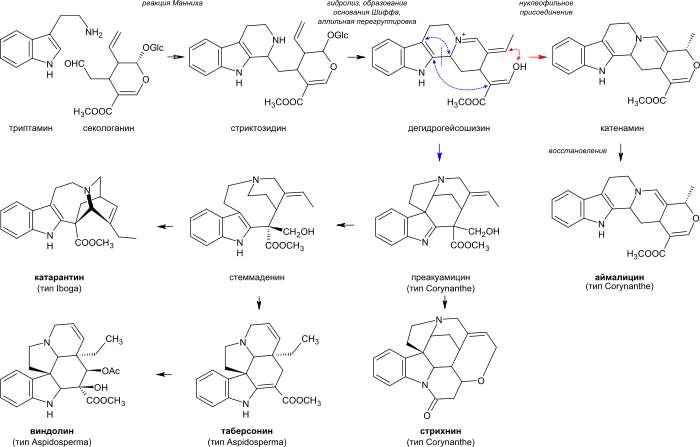
Большинство монотерпеноидных алкалоидов включают в состав остаток C9 или C10, происходящий от секологанина. В зависимости от структуры этого остатка такие алкалоиды подразделяют на три типа: тип Corynanthe, тип Iboga и тип Aspidosperma (по названиям типичных родов или видов растений, в которых содержатся такие алкалоиды). Ниже представлены углеродные скелеты монотерпеноидной части на примере алкалоидов аймалицина, катарантина и таберсонина. Кружком обозначены атомы углерода, отсутствующие в молекулах алкалоидов, включающих терпеноидный остаток C9 (в отличие от C10)[14].
Алкалоиды типа Corynanthe включают в себя скелет секологанина в неизменном виде, а алкалоиды типов Iboga и Aspidosperma — в перегруппированном виде[23]. Некоторые представители монотерпеноидных индольных алкалоидов[5][24][25]:
Тип Атомов углерода в монотерпеноидной части C9 C10 Corynanthe Аймалин (англ. ajmaline), акуамицин, стрихнин, бруцин Аймалицин (раубазин), йохимбин, резерпин, сарпагин, вобазин, митрагинин Iboga Ибогаин, ибогамин Катарантин, воакангин (англ. voacangine) Aspidosperma Эбурнамин Таберсонин, виндолин, винкамин Существует также небольшая группа алкалоидов Аристотелии (около 30 соединений, важнейшим из которых является педункуларин), содержащих монотерпеноидную часть (C10), происходящую не от секологанина[26].
Бисиндольные алкалоиды
Известно более 200 димерных индольных (бисиндольных) алкалоидов, получаемых в живых организмах посредством димеризации мономерных индольных оснований. Бисиндольные алкалоиды обычно образуются в процессе следующих реакций[27]:
- Реакция Манниха (плейомутин, воакамин);
- Реакция Михаэля (виллальстонин);
- конденсация альдегидов с аминами — токсиферин, калебассин;
- Окислительное сочетание триптаминов (каликантин);
- Расщепление функциональной группы одного из мономеров (винбластин, винкристин).
Помимо бисиндольных алкалоидов существуют димерные алкалоиды, образующиеся в процессе димеризации индольного мономера с алкалоидом другого типа. Примером является тубулозин, состоящий из индольного и изохинолинового структурных элементов[28].
Распространение в природе
Среди растений, богатых неизопреноидными индольными алкалоидами, можно выделить гармалу (лат. Peganum harmala), содержащую гарман, гармин и гармалин, а также физостигму ядовитую (лат. Physostigma venenosum), содержащую физостигмин[29]. Некоторые представители семейства Вьюнковые (лат. Convolvulaceae), в частности, утреннее сияние (лат. Ipomoea violacea) и Rivea corymbosa, содержат производные лизергиновой кислоты[30].
Индольные алкалоиды найдены в растениях из 39 семейств[31]. Несмотря на значительное структурное многообразие, большая часть монотерпеноидных индольных алкалоидов локализована в трёх семействах двудольных: Кутровые (лат. Apocynaceae) — 73 вида[31], в частности, роды Альстония (лат. Alstonia), Аспидосперма (лат. Aspidosperma), Раувольфия (лат. Rauvolfia) и Катарантус (лат. Catharanthus); Мареновые (лат. Rubiaceae) — 72 вида[31], в частности, род Коринанте (лат. Corynanthe), и Логаниевые (лат. Loganiaceae) — 40 видов[31], в частности, род Стрихнос (лат. Strychnos)[32][33]. Довольно богато индольными алкалоидами и семейство Бобовые (Fabaceae), в котором 63 вида содержат алкалоиды этой группы, но здесь они в основном простые по строению[31].
Среди грибов, содержащих индольные алкалоиды, можно выделить род Псилоцибе (лат. Psilocybe), представители которого содержат простые производные триптамина, а также род Спорынья (лат. Claviceps), представители которого богаты производными лизергиновой кислоты[29].
Индольные алкалоиды играют роль также и в организмах животных. В коже многих видов жаб рода Bufo обнаружено производное триптамина — буфотенин, а в коже колорадской жабы Bufo alvarius — 5-MeO-DMT[34]. Серотонин, важный нейромедиатор у млекопитающих, также может быть отнесён к простейшим индольным алкалоидам.[35]
-
Гармала, содержащая β-карболиновые алкалоиды
-
«Утреннее сияние» (лат. Ipomoea violacea) содержит производные лизергиновой кислоты
-
Раувольфия змеиная содержит алкалоиды типа Corynanthe
-
Катарантус розовый содержит монотерпеноидные индольные алкалоиды
-
Psilocybe cubensis содержит псилоцин и псилоцибин
-
Спорынья содержит производные лизергиновой кислоты
Биосинтез
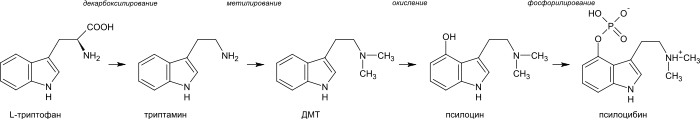
Биогенетическим предшественником всех индольных алкалоидов является аминокислота триптофан. Для большинства из них первым шагом является декарбоксилирование триптофана с образованием триптамина. Диметилтриптамин (ДМТ) образуется из триптамина посредством метилирования при участии кофермента S-аденозилметионина (SAM). Псилоцин образуется из диметилтриптамина посредством окисления и в дальнейшем фосфорилируется до псилоцибина[13].
При биосинтезе серотонина промежуточным соединением является не триптамин, а 5-гидрокситриптофан, который уже в свою очередь декарбоксилируется с образованием 5-гидрокситриптамина (серотонина)[13].
Биосинтез β-карболиновых алкалоидов происходит посредством образования основания Шиффа из триптамина и альдегида (или кетокислоты) и последующей внутримолекулярной реакции Манниха, где атом углерода C2 индольного ядра выступает в роли нуклеофила. После этого ароматичность восстанавливается с потерей протона при атоме углерода C2. Получившийся тетрагидро-β-карболиновый скелет затем последовательно окисляется до дигидро-β-карболинового и β-карболинового. При образовании простых β-карболиновых алкалоидов, таких как гармин и гармалин роль кетокислоты выполняет пировиноградная кислота. При синтезе монотерпеноидных индольных алкалоидов в качестве альдегида участвует секологанин. Пирролоиндольные алкалоиды синтезируются в живых организмах аналогичным способом[36].
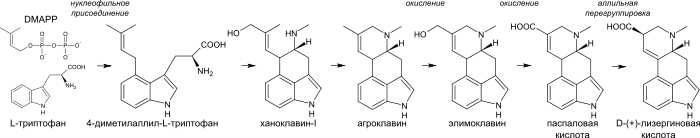
Биосинтез алкалоидов спорыньи начинается с алкилирования триптофана диметилаллилпирофосфатом (англ. Dimethylallyl pyrophosphate), при этом атом углерода C4 индольного ядра играет роль нуклеофила. Образовавшийся 4-диметилаллил-L-триптофан подвергается N-метилированию. Дальнейшими ступенями биосинтеза являются ханоклавин-I и агроклавин. Последний гидроксилируется до элимоклавина, который в свою очередь окисляется до паспаловой кислоты. В процессе аллильной перегруппировки паспаловая кислота преобразуется в лизергиновую кислоту[37].
Биосинтез монотерпеноидных индольных алкалоидов начинается реакцией Манниха с участием триптамина и секологанина, в результате которой образуется стриктозидин, преобразуемый в дальнейшем в 4,21-дегидрогейсошизин. Далее биосинтез большинства алкалоидов с неперегруппированной монотерпеноидной частью (типа Corynanthe) продолжается посредством циклизации с образованием катенамина и последующего восстановления до аймалицина в присутствии никотинамидадениндинуклеотидфосфата (NADPH). При биосинтезе других алкалоидов 4,21-дегидрогейсошизин сначала преобразуется в преакуамицин, алкалоид подтипа Strychnos типа Corynanthe, из которого в свою очередь образуются другие алкалоиды подтипа Strychnos, а также алкалоиды типов Iboga и Aspidosperma. Бисиндольные алкалоиды винбластин и винкристин получаются в процессе реакции, вовлекающей катарантин (алкалоид типа Iboga) и виндолин (алкалоид типа Aspidosperma)[24][38].
Физиологическая активность
Многие индольные алкалоиды обладают заметной физиологической активностью. Большая часть физиологических эффектов индольных алкалоидов связана с их действием на центральную и периферическую нервные системы. Кроме того, бисиндольные алкалоиды винбластин и винкристин обладают противоопухолевым эффектом[39].
Действие на аминергические системы
 Молекула лизергиновой кислоты содержит структурные элементы как триптамина (слева), так и фенилэтиламина (справа)
Молекула лизергиновой кислоты содержит структурные элементы как триптамина (слева), так и фенилэтиламина (справа)
Благодаря структурному сходству с серотонином многие триптамины способны взаимодействовать с серотониновыми (5-HT) рецепторами[40]. Так, основной эффект классических галлюциногенов, таких как ДМТ, псилоцин и псилоцибин, связан с тем, что эти вещества являются агонистами по отношению к 5-HT2A рецепторам[41]. Галлюциногенные эффекты ибогаина также связывают с подобным действием[42]. Грамин, напротив, является антагонистом 5-HT2A-рецепторов[43].
Производные лизергиновой кислоты включают в свой состав структурные элементы как триптамина, так и фенилэтиламина, что позволяет им действовать как на 5-HT рецепторы, так и на адренорецепторы (в основном типа α) и дофаминовые рецепторы (главным образом типа D2)[44][45]. Так, эрготамин является частичным агонистом α-адренорецепторов и 5-HT2-рецепторов, благодаря чему обладает сосудосуживающим действием и стимулирует сокращения матки. Дигидроэрготамин обладает большей селективностью в отношении α-адренорецепторов и меньшим действием на серотониновые рецепторы. Эргометрин является агонистом α-адренорецепторов и 5-HT2-рецепторов и частичным агонистом D2-рецепторов[45][46]. По сравнению с другими алкалоидами спорыньи эргометрин обладает большей селективностью в отношении стимуляции матки[46]. ЛСД, синтетическое производное лизергиновой кислоты, является агонистом 5-HT2A- и 5-HT1A-рецепторов, а также, в меньшей степени, D2-рецепторов и обладает мощным галлюциногенным эффектом[47][48].
Некоторые монотерпеноидные индольные алкалоиды также взаимодействуют с адренорецепторами. Например, аймалицин (раубазин) является селективным антагонистом α1-адренорецепторов, благодаря чему обладает антигипертензивным эффектом[49][50]. Йохимбин же более селективен в отношении α2-адренорецепторов[50]. Благодаря блокированию пресинаптических α2-адренорецепторов йохимбин увеличивает выброс норадреналина, что приводит к повышению кровяного давления. Йохимбин применялся для лечения эректильной дисфункции у мужчин до появления более совершенных препаратов[51].
Некоторые алкалоиды влияют на оборот моноаминов косвенным образом. Так, гармин и гармалин являются обратимыми селективными ингибиторами моноаминоксидазы-A[52]. Резерпин опустошает запасы моноаминов в пресинаптических нейронах, уменьшая их концентрацию в синапсе, следствием чего является его антигипертензивное и антипсихотическое действия[49].
Действие на другие системы
Некоторые индольные алкалоиды взаимодействуют и с другими типами рецепторов. Так, митрагинин является агонистом μ-опиоидных рецепторов[25]. Алкалоиды гармалы являются антагонистами к ГАМКА-рецепторам[53], а ибогаин — к NMDA-рецепторам[54].
Физостигмин является обратимым ингибитором ацетилхолинэстеразы[55].
Применение
Применения индольных алкалоидов и их синтетических аналогов связаны с их физиологической активностью.
Медицинское применение
Растения и грибы, содержащие индольные алкалоиды, имеют давнюю историю применения в народной медицине. Раувольфия змеиная, действующим веществом которой является резерпин, на протяжении более 3000 лет применялась в Индии в качестве средства от змеиных укусов и для лечения сумасшествия[56]. В средневековой Европе микстуры, содержащие рожки спорыньи, использовались для медикаментозных абортов[57].
Позднее чистые препараты индольных алкалоидов также стали использоваться в медицине. Уже упоминавшийся резерпин был вторым (после хлорпромазина) принятым к применению антипсихотиком, однако его использование для этой цели было ограничено низким терапевтическим индексом и сильно выраженными побочными эффектами. В настоящее время в качестве антипсихотика резерпин не применяется[58], но иногда используется в качестве антигипертензивного средства, чаще в комбинации с другими действующими веществами[59].
К другим препаратам, влияющим на сердечно-сосудистую систему относятся аймалин (англ. Ajmaline), являющийся антиаритмическим средством класса I[60], и аймалицин (раубазин), используемый в Европе в качестве антигипертензивного средства[49]. Физостигмин, ингибитор ацетилхолинэстеразы, используется для уменьшения глазного давления при глаукоме, а его синтетические аналоги применяются при болезни Альцгеймера (ривастигмин) и миастении (неостигмин, пиридостигмин, дистигмин)[61].
Алкалоиды спорыньи эргометрин (эргобазин, эргоновин) и эрготамин, а также их синтетические производные, такие как метилэргометрин (англ. Methylergometrine) применяются при маточных кровотечениях[62]. Бисиндольные алкалоиды винбластин и винкристин используются в качестве противоопухолевых средств[63].
Исследования на животных показали, что ибогаин может быть эффективен при лечении героиновой, кокаиновой и алкогольной зависимостей, а также облегчать симптомы отмены опиоидов. Это действие связывают в основном с антагонизмом ибогаина по отношению к NMDA-рецепторам. Медицинскому применению ибогаина в значительной степени препятствует его юридический статус (во многих странах он запрещён как мощный галлюциноген с опасными последствиями передозировки), однако в Европе и США существуют «подпольные» сети, предоставляющие медицинские услуги наркоманам[64][65].
Немедицинское применение
Природные источники некоторых индольных алкалоидов с древних времён используются в качестве галлюциногенов. К ним относятся, в частности, галлюциногенные грибы рода Псилоцибе, употреблявшиеся ещё ацтеками[66]. Другим давно применяемым галлюциногеном является айяуаска — южноамериканский психотропный чай, приготовляемый из растений Psychotria viridis и Banisteriopsis caapi. Первое из них богато диметилтриптамином (ДМТ), являющимся галлюциногеном, а второе содержит большое количество β-карболиновых алкалоидов (гармин, гармалин, тетрагидрогармин) — ингибиторов моноаминоксидазы. Считается, что основное действие β-карболинов в айяуаске сводится к предотвращению метаболизации ДМТ в пищеварительном тракте и печени, благодаря чему он получает возможность преодолеть гематоэнцефалический барьер. Прямое действие β-карболинов на центральную нервную систему минимально[67]. Яд жаб Bufo Alvarius, содержащий 5-MeO-DMT, также используется с целью испытания галлюцинаций[68].
Из полусинтетических триптаминов широко применяется диэтиламид лизергиновой кислоты (ЛСД) — сильный галлюциноген, эффективный в дозах 30—40 мкг при пероральном употреблении[69].
Примечания
- ↑ 1 2 3 4 Кнунянц И. Л. Индольные алкалоиды // Химическая энциклопедия. — М.: Советская энциклопедия, 1988. — 623 с.
- ↑ David S. Seigler. Plant secondary metabolism. — Springer, 2001. — С. 628. — 776 с. — ISBN 0412019817
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 348—367. — 515 с. — ISBN 0471496405
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — С. 333—335. — 414 с. — ISBN 978-3-906390-24-6
- ↑ 1 2 Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — С. 316. — 414 с. — ISBN 978-3-906390-24-6
- ↑ Орехов А. П. Химия алкалоидов. — Изд.2. — М.: АН СССР, 1955. — С. 616. — 859 с.
- ↑ Л. Эльдерфилд. Гетероциклические соединения. — М.: Издательство иностранной литературы, 1954. — Т. 3. — С. 5.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 346—376. — 515 с. — ISBN 0471496405
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — С. 14—30. — 414 с. — ISBN 978-3-906390-24-6
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — С. 91—92. — 414 с. — ISBN 978-3-906390-24-6
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — С. 15. — 414 с. — ISBN 978-3-906390-24-6
- ↑ Leland J. Cseke et al. Natural Products from Plants. Second Edition. — CRC, 2006. — С. 30. — 569 с. — ISBN 0-8493-2976-0
- ↑ 1 2 3 4 Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 347. — 515 с. — ISBN 0471496405
- ↑ 1 2 Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 350. — 515 с. — ISBN 0471496405
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — С. 16. — 414 с. — ISBN 978-3-906390-24-6
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 349. — 515 с. — ISBN 0471496405
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — С. 22. — 414 с. — ISBN 978-3-906390-24-6
- ↑ Орехов А. П. Химия алкалоидов. — Изд.2. — М.: АН СССР, 1955. — С. 565. — 859 с.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 365—366. — 515 с. — ISBN 0471496405
- ↑ Орехов А. П. Химия алкалоидов. — Изд.2. — М.: АН СССР, 1955. — С. 601. — 859 с.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 370—372. — 515 с. — ISBN 0471496405
- ↑ 1 2 Орехов А. П. Химия алкалоидов. — Изд.2. — М.: АН СССР, 1955. — С. 627. — 859 с.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 351. — 515 с. — ISBN 0471496405
- ↑ 1 2 Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 350—359. — 515 с. — ISBN 0471496405
- ↑ 1 2 Hiromitsu Takayama. Chemistry and Pharmacology of Analgesic Indole Alkaloids from the Rubiaceous Plant, Mitragyna speciosa // Chem. Pharm. Bull. — 2004. — Т. 52. — № 8. — С. 916—928.
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — С. 30. — 414 с. — ISBN 978-3-906390-24-6
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — С. 91—105. — 414 с. — ISBN 978-3-906390-24-6
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — С. 99. — 414 с. — ISBN 978-3-906390-24-6
- ↑ 1 2 Monika Waksmundzka-Hajnos, Joseph Sherma, Teresa Kowalska. Thin layer chromatography in phytochemistry. — CRC Press, 2008. — С. 625—626. — 865 с. — ISBN 978-1-4200-4677-9
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: Elsevier, 2007. — С. 39. — 335 с. — ISBN 978-0-444-52736-3
- ↑ 1 2 3 4 5 Блинова К. Ф. и др. Ботанико-фармакогностический словарь: Справ. пособие / Под ред. К. Ф. Блиновой, Г. П. Яковлева. — М.: Высш. шк., 1990. — С. 10. — ISBN 5-06-000085-0
- ↑ Monika Waksmundzka-Hajnos, Joseph Sherma, Teresa Kowalska. Thin layer chromatography in phytochemistry. — CRC Press, 2008. — С. 626. — 865 с. — ISBN 978-1-4200-4677-9
- ↑ Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: Elsevier, 2007. — С. 37—39. — 335 с. — ISBN 978-0-444-52736-3
- ↑ Michael E. Peterson, Patricia A. Talcott. Small Animal Toxicology. — Saunders, 2005. — С. 1086. — 1190 с. — ISBN 0721606393
- ↑ Monika Waksmundzka-Hajnos, Joseph Sherma, Teresa Kowalska. Thin layer chromatography in phytochemistry. — CRC Press, 2008. — С. 625. — 865 с. — ISBN 978-1-4200-4677-9
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 349, 365. — 515 с. — ISBN 0471496405
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 369—370. — 515 с. — ISBN 0471496405
- ↑ Tadhg P. Begley. Encyclopedia of Chemical Biology. — Wiley, 2009. — С. 5—7. — 3188 с. — ISBN 978-0-471-75477-0
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 356. — 515 с. — ISBN 0471496405
- ↑ Richard A. Glennon. Strategies for the Development of Selective Serotonergic Agents // The Serotonin Receptors. From Molecular Pharmacology to Human Therapeutics. — Humana Press, 2006. — С. 96. — 618 с. — ISBN 1-58829-568-0
- ↑ Richard A. Glennon. Neurobiology of Hallucinogens // The American Psychiatric Publishing textbook of substance abuse treatment. — American Psychiatric Publishing, 2008. — С. 183. — 616 с. — ISBN 978-1-58562-276-4
- ↑ Kenneth R. Alper. Ibogaine: a Review // The Alkaloids. — Academic Press, 2001. — С. 8. — ISBN 0120532069
- ↑ Froldi Guglielmina; Silvestrin Barbara; Dorigo Paola; Caparrotta Laura. Gramine: A vasorelaxing alkaloid acting on 5-HT2A receptors // Planta medica. — 2004. — Т. 70. — № 4. — С. 373—375.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 374—375. — 515 с. — ISBN 0471496405
- ↑ 1 2 B. T. Larson et al. Ergovaline Binding and Activation of D2 Dopamine Receptors in GH4ZR7 Cells // J Anim Sci. — 1995. — Т. 73. — С. 1396—1400.
- ↑ 1 2 Bertram G. Katzung. Basic & clinical pharmacology. — McGraw-Hill Medical, 2009. — С. 272. — 1200 с. — ISBN 0071604057
- ↑ Torsten Passie et al. The Pharmacology of Lysergic Acid Diethylamide: A Review // CNS Neuroscience & Therapeutics. — 2008. — Т. 14. — С. 295—314.
- ↑ Philip Seeman. Comment on «Diverse Psychotomimetics Act Through a Common Signaling Pathway» (англ.) (9 July 2004). Архивировано из первоисточника 14 августа 2011. Проверено 31 октября 2009.
- ↑ 1 2 3 Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 353. — 515 с. — ISBN 0471496405
- ↑ 1 2 P. Demichel et al. alpha-Adrenoceptor blocking properties of raubasine in pithed rats // J Pharmacol. — 1982. — Т. 77. — № 3. — С. 449—454.
- ↑ Bertram G. Katzung. Basic & clinical pharmacology. — McGraw-Hill Medical, 2009. — С. 145. — 1200 с. — ISBN 0071604057
- ↑ Andreas Moser. Pharmacology of endogenous neurotoxins: a handbook. — Braun-Brumfield, 1998. — С. 138. — ISBN 3-7643-3993-4
- ↑ Andreas Moser. Pharmacology of endogenous neurotoxins: a handbook. — Braun-Brumfield, 1998. — С. 131. — ISBN 3-7643-3993-4
- ↑ Kenneth R. Alper. Ibogaine: a Review // The Alkaloids. — Academic Press, 2001. — С. 7. — ISBN 0120532069
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 367. — 515 с. — ISBN 0471496405
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 352. — 515 с. — ISBN 0471496405
- ↑ Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — С. 332—333. — 414 с. — ISBN 978-3-906390-24-6
- ↑ Alan F. Schatzberg, Charles B. Nemeroff. The American Psychiatric Publishing Textbook of Psychopharmacology. — The American Psychiatric Publishing, 2009. — С. 533. — 1648 с. — ISBN 9781585623099
- ↑ Симпатолитики — Энциклопедия лекарств РЛС (рус.). Архивировано из первоисточника 14 августа 2011. Проверено 4 ноября 2009.
- ↑ Антиаритмические средства — Энциклопедия лекарств РЛС (рус.). Архивировано из первоисточника 14 августа 2011. Проверено 4 ноября 2009.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 367—368. — 515 с. — ISBN 0471496405
- ↑ Утеротоники — Энциклопедия лекарств РЛС (рус.). Архивировано из первоисточника 14 августа 2011. Проверено 4 ноября 2009.
- ↑ Противоопухолевые средства растительного происхождения — Энциклопедия лекарств РЛС (рус.). Архивировано из первоисточника 14 августа 2011. Проверено 4 ноября 2009.
- ↑ Kenneth R. Alper. Ibogaine: a Review // The Alkaloids. — Academic Press, 2001. — С. 2—19. — ISBN 0120532069
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 357. — 515 с. — ISBN 0471496405
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 348. — 515 с. — ISBN 0471496405
- ↑ Jordi Riba et al. Human Pharmacology of Ayahuasca: Subjective and Cardiovascular Effects, Monoamine Metabolite Excretion, and Pharmacokinetics // Journal of Pharmacology And Experimental Therapeutics. — 2003. — Т. 306. — № 1. — С. 73—83.
- ↑ Weil AT, Davis W. Bufo alvarius: a potent hallucinogen of animal origin // J Ethnopharmacol. — 1994. — Т. 41. — № 1—2. — С. 1—8.
- ↑ Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — С. 376. — 515 с. — ISBN 0471496405
Литература
- Орехов А. П. Химия алкалоидов. — 2-е изд. — М.: АН СССР, 1955. — 859 с.
- Племенков В. В. Введение в химию природных соединений. — Казань, 2001. — 376 с.
- Tadeusz Aniszewski. Alkaloids — secrets of life. — Amsterdam: Elsevier, 2007. — 335 с. — ISBN 978-0-444-52736-3
- Manfred Hesse. Alkaloids. Nature’s Curse or Blessing. — Wiley-VCH, 2002. — 414 с. — ISBN 978-3-906390-24-6
- Paul M Dewick. Medicinal Natural Products. A Biosynthetic Approach. Second Edition. — Wiley, 2002. — 515 с. — ISBN 0471496405
Основные типы алкалоидов Пирролидин Гигрин Тропан Атропин • Гиосциамин • Скополамин • Кокаин • Экгонин Пиперидин Кониин • Лобелин • Пиперин Хинолизидин Цитизин • Пахикарпин Пиридин Никотин • Анабазин Изохинолин Морфин • Кодеин • Тебаин • Папаверин • Ликорин Хинолин Хинин • Хинидин • Эхинопсин Индол Серотонин • Псилоцин • Псилоцибин • ДМТ • 4-HO-MET • 5-MeO-DMT • Буфотенин • Гармин • Гармалин • Физостигмин • Эрготамин • Эргометрин • Иохимбин • Резерпин • Митрагинин • Ибогаин • Стрихнин • Бруцин Пурин Ксантины (Кофеин • Теобромин • Теофиллин) • Сакситоксин Фенилэтиламин Катехоламины (Норадреналин • Адреналин • Дофамин) • Эфедрин • Псевдоэфедрин • Норэфедрин • Катин • Катинон • Мескалин Терпены Аконитин • Дельфинин • Элатин Другие Пилокарпин • Мускарин • Мускаридин • Колхицин • Галантамин • Капсаицин Эта статья входит в число хороших статей русскоязычного раздела Википедии. Категории:- Алкалоиды
- Производные индола
- Неизопреноидные:
Wikimedia Foundation. 2010.